1. 정성분석과 정량분석
정성분석(qualitative analysis): 특정물질(원자단, 관능기 등)이 존재하냐를 분석
정량분석(quantitative analysis): 특정물질이 시료중에 얼마나있는지 (함량) 를 분석
2. 시약과 표준물질
시약(reagent): 순도가 높은것 -> 불순물에 의한 오차를 최소화 (규격, 순도, 불순물의 한도 명시)
시약의 종류: 1) 일반용시약, 2) 분석용시약, 3) 특수용시약
분석용시약의 예시로 고순도의 NaCl, KHP, 삼산화비소 등 1차표준물질로 쓰이는 것들이 있는 것임
-> 표준물질!
순도가 매우 높은 표준물질 (99.95% 이상) 로 표정(standardization)한 표준액(standard solution)으로
미지물질의 순도/농도를 측정한다.

3. 정제수
1) 증류수(distilled water; DW) : 증류법을 이용 (이온은 그대로)
2) 탈이온수(deionized distilled water; DDW): 이온교환수지 통과 (이온도 제거)
3) 역삼투수(reverse osmosis water; ROW): 역삼투막으로 정제 (이온도 제거)
4. 분석용 기구의 재질
유리, 석영유리(silica, quartz), 자기, 백금, 플라스틱 등 있는데
석영유리는 자외부(UV)의 빛을 투과시키는 성질이 있어 UV spectrometer의 시료용기로 사용 (GC, 전기영동용 모세관 칼럼의 재료로도 쓰임)
5. 용매(solvent)(액체) + 용질(solute)(고, 액, 기) -> 균일하게 섞인 상태 -> 용액(solution)
용매(solvent)는 화학반응에 직접 참여하는 게 아니라 극성(polarity), 온도 등 환경을 제공
1) 극성 수소원자 유무로 분류
- 유 : 양성자성 용매 (protic solvent) : O, N, X와 결합된 극성수소가 존재하거나 수소이온(H+)을 제공할 수 있는 용매
ex. 물, 알코올, HX, 초산, 암모니아 등
- 무 : 비양성자성 용매 (aprotic solvent) : 비극성 유기용매 (ex. 벤젠, CCl4(사염화탄소))
2) 물이 용매로 쓰였냐
- O : 수용액
- X : 비수용액 (*예를들어 비수적정에서 쓰임(물에서의 전리상수값이 너무 작은물질이 대상))
6. 용해도 (solubility)
*여담: BCS class에서는 solubility와 permeability로 약물을 4가지 군으로 구분
용해도를 결정하는 주요 인자
1) 극성(polarity) : 용질과 용매의 극성은 평행한다.
2) 온도 : 보통 고체,액체는 온도가 높아질수록 용해도 증가, 기체는 온도가 높아질수록 용해도 감소 (예외도 많음)
3) 압력 : 이것도 용질의 특성에 따라 다른데,
기체용질은 기체분압에 따라 용해도 증가할 수 있음(Henry의 법칙), 고체/액체 용질은 압력에 따른 용해도 차이 거의 없음
- 일반적으로 표준상태(25'C, 1기압)에서 압력과 온도의 영향 무시할 수 있음
7. 농도 (concentration)
1) 퍼센트농도 (백분율)
x g / 100g = 무게퍼센트 (% = w/w%)
x mL / 100mL = 부피퍼센트 (v/v%)
x g / 100mL = 그램농도(gramarity) (w/v%)
‰ = 천분율 (퍼센트농도의 1/10)
2) 백만분율(ppm) , 십억분율(ppb)
- 백만분율(parts per million; ppm): 시료 1kg 중 목적성분의 mg 수 (xmg/1kg = x의 10^(-6)g)
밀도가 1.00g/mL에 가까운 수용액에서는 1㎍/mL (=1mg/L) 에 해당함
ppmv(용량백만분율; vol ppm; 시료기체 1L 중 목적기체의 ㎕수)도 있음. 이와 구분하기 위해 ppmw(질량백만분율)으로 쓰기도 함.
- 십억분율(parts per billion; ppb): 시료 1kg 중 목적성분의 ㎍수
ppb의 1/1000에 해당하는 농도는 pptr(parts per trillion)이라고 함
3) 몰농도 (molarity; mol/L)
용액 1L 중의 용질의 몰수(mol)
단위는 M 또는 mol/L
4) 몰랄농도 (molality; m)
용매 1kg 중의 용질의 몰수(mol)
단위는 m
몰농도는 온도에 의존하는데, 몰랄농도는 온도에 의존하지 않음 -> 물질의 물리적 성질(어는점내림, 끓는점오름, 삼투압 등) 측정시에 이용
5) 포르말농도 (formailty; F) (=화학식량 농도=분석농도)
화학식량의 배수 / 1L
(몇배인지는 상황에 따라 다름)
물질의 화학식량(formula weight; F.W.)은 화학식 단위의 질량을 말함. 예를 들어 AlCl3의 화학식량은 133.341
그런데, 실제 분자는 Al2Cl6의 조성을 갖는 이합체로 존재하기 때문에 대부분 비극성 유기용매 중에서의 실제 분자량은 화학식량의 2배임 -> 2F
또한 포르말농도는 용액 내에서의 물질의 실제적인 조성을 모를 때 단지 녹아있는 물질의 양을 표현할떄도 사용됨.
예를 들어 1mol의 HCl을 물에 녹여 1L로 만든 용액에서, HCl 분자는 해리돼서 분자의 실제 농도는 거의 0이됨.
이 용액의 HCl농도는 1mol/L 라고 하는것보다 1F라고 하는게 더 정확하다는 것임. (H+, Cl-는 각각 1mol/L, HCl은 0mol/L이자 1F)
하지만 대부분의 경우에 포르말농도와 몰농도를 구별하지 않고 사용함
특정 화합물에 대한 화학조성을 완전히 알지 못하면 진정한 몰농도는 거의 알수없지만, 포르말농도는 용액중에 들어있는 물질의 양을 무게를 달거나 분석방법에 의해 측정해서 알수있음 -> 분석농도(analytical concentration)라고도 함
6) 노르말농도(normailty; N)
그램 당량수 / 1L
용액 1L 중의 용질의 그램당량수를 노르말농도 또는 규정농도라고 함.
1그램당량은 이온화할수있는 수소 1.008g을 포함하는 물질의 g수를 말함.
순수한 HCl 36.465g (HCl 1mol) 중에는 이온화할수있는 수소가 1.008g (1mol) 있기 때문에 HCl의 1그램당량은 36.465g이고 HCl의 1N용액은 1mol/L 용액과 같음.
순수한 H2SO4(화학식량 98) 1mol에는 이온화할수있는 수소가 2.016g 포함되어 있음 -> 황산 1mol은 2그램당량 -> 1N H2SO4는 그 액 1L 중에 49g의 H2SO4를 포함하므로 0.5mol/L 용액임
(달리표현하면, 1mol/L H2SO4 용액 중에는 총 1.008 * 2 g의 이온화할수있는 수소가 있는 것 -> 1mol/L H2SO4 = 2N H2SO4)
염기 1그램당량은 산 1그램당량을 중화하는 데 필요한 그램수임
7) 몰분율 (mole fraction)
용액 중 어떤 성분의 몰수 / 전체 성분의 몰수의 합 = 몰분율
( 용액 중 어떤 성분의 몰수 / 전체 성분의 몰수의 합 ) * 100 = 몰백분율
혼합물의 물리화학적 성질 기술/측정시 사용됨
8. 농도의 환산
* 0.1mol/L HCl 500mL 조제하고 싶어 (F.W. = 36.46, 순도 35%, 비중 1.18)
1) 0.1mol/L = 0.05mol/500mL (몇 몰 필요한지 알기)
2) 0.05mol * (36.46g / 1mol) = 1.823 g (몰수를 그램으로 변환)
3) 1.823g : 35% = x g : 100%
x = (1.823 * 100 ) / 35 = 5.2086 g (순도 반영)
4) 5.2086g / x mL = 1.18g / 1mL
x = (5.2086 * 1) / 1.18 = 4.4140mL (비중(밀도) 반영)
=> 정리

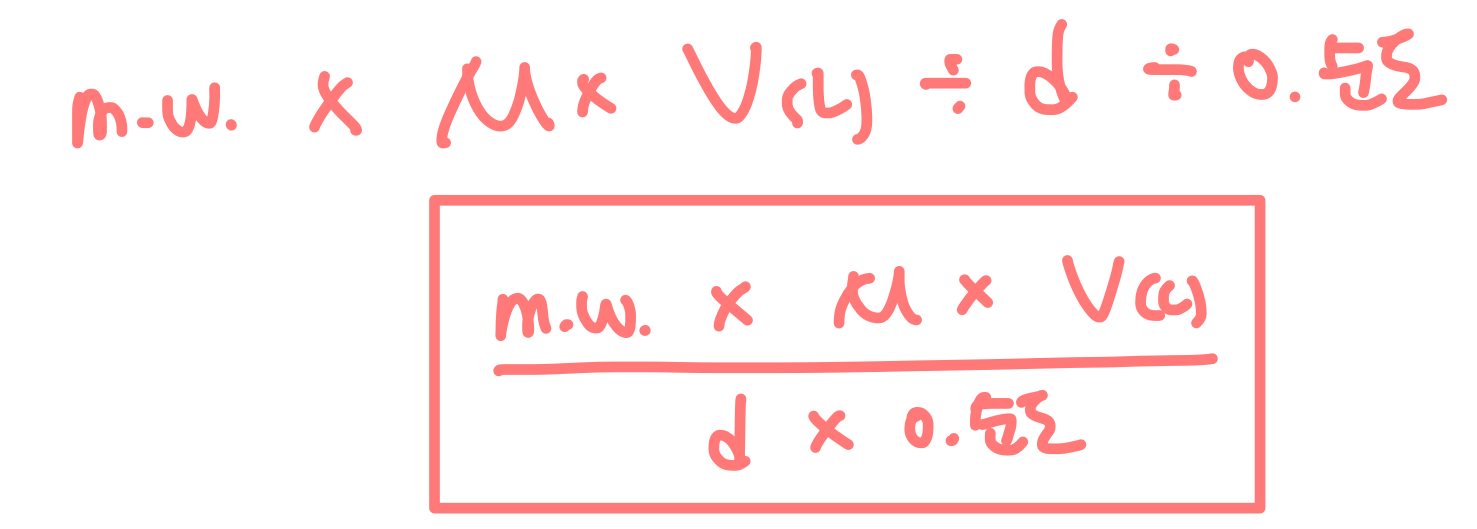
| 산/염기 | (%) | 비중 | 몰농도 |
| 아세트산 (CH3COOH) | 99.5 | 1.05 | 17.4 |
| 염산 (HCl) | 37 | 1.19 | 12 |
| 질산 (HNO3) | 72 | 1.42 | 15.7 |
| 과염소산 (HClO4) | 70~72 | 1.68 | 11.6 |
| 인산 (H3PO4) | 85 | 1.69 | 14.7 |
| 황산 (H2SO4) | 95 | 1.83 | 18 |
| 암모니아 (NH3) | 28 | 0.90 | 14.8 |
▲표: 주로 사용되는 진한 산/염기의 농도 등
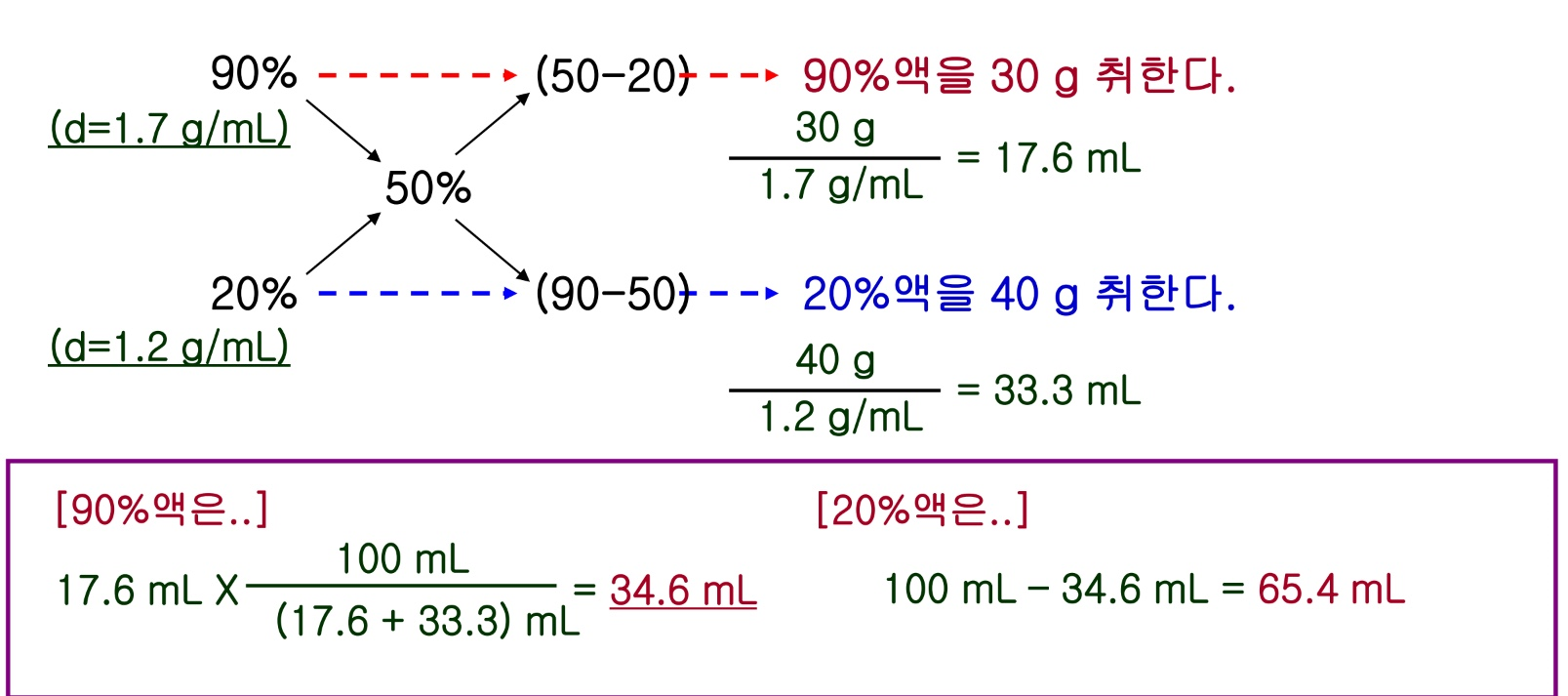
- 진한 용액 희석 / 희박한 용액을 진한용액으로 농도 높이고 싶을 때
a% 액을 b%액 (물일때는 b=0) 으로 희석시켜 x%액을 만들려면,

ex. 90%액과 20%액을 혼합하여 50%의 용액 100ml를 만들고 싶다. (각각의 밀도는 1.7, 1.2g/ml)
각각 얼마씩 섞으면 될까?
- 의약품분석학 개정3판 (동명사) 예제, 연습문제 문제 풀이


- 여담
기본개념이다~
'2학년 > 의약품분석학' 카테고리의 다른 글
| 1-2 화학평형 - 3) 산염기와 물의 해리 (1) | 2023.12.28 |
|---|---|
| 1-2 화학평형 (1) | 2023.12.22 |

