( pc인터넷 환경에서 보시면 수식이 제대로 보입니다 )
1. 평형상수
A + B ↔ C + D 라는 반응에서,
열역학 제2법칙 (반응의 자발성, 방향성 결정) 에 따라 자유에너지 변화량을 표현하면 다음과 같다.
\(\Delta G=\Delta G^{\circ }+RT\ln \dfrac{\left[ C\right] \left[ D\right] }{\left[ A\right] \left[ B\right] }\)
여기서 R은 기체상수, T는 절대온도, 델타G는 자유에너지 변화량이다.
\(\Delta G^{\circ }\)는 반응물과 생성물의 표준생성자유에너지의 변화량(델타값)이다. 식에 의해 구할수있음
여기서 \(\Delta G\)는 이 반응의 추진력이다. 어느 시점에 이르러 추진력을 잃게 되면 \(\Delta G=0\)의 상태가 되고, 이를 평형상태라고 한다. (동적평형) 즉 \(\Delta G=0\rightarrow \Delta G^{\circ }=-RT\ln \dfrac{\left[ C\right] _{eq}\left[ D\right] _{eq}}{\left[ A\right] _{eq}\left[ B\right] eq}=-RT\ln K\)
여기서 [N]eq는 각각 화학종의 평형상태에서의 농도를 말하며, 이들의 비율이 곧 평형상수 K = \( \ln \dfrac{\left[ C\right] _{eq}\left[ D\right] _{eq}}{\left[ A\right] _{eq}\left[ B\right] eq}\) 이다. ( 질량작용의 법칙과 같은 결론 )
* 평형상수 K의 단위는 없다
* 농도는 용질의 몰농도 mol/L 로, 기체는 기압으로 나타낸다.
* 순수한 고체/액체/용매의 농도는 상수 1로 간주하여 생략한다.
2. 르 샤틀리에 법칙
어느 열역학적 평형계가 외부로부터의 작용 (온도, 압력, pH, 반응물이나 생성물의 농도의 변화 등) 으로 평형이 깨지면
-> 그 작용의 효과가 감소하는 방향으로 계의 상태가 변화한다.
=> 결국 질량작용의 법칙과 르 샤틀리에 법칙은 둘다 반응의 평형상수는 항상 일정하게 유지된다는 것을 말해준다.
3. 전해질 용액과 전리도
전해질(electrolyte) : 물에 녹였을 때 그 용액이 전기전도성을 갖는 물질 ex. 산, 알칼리, 염 등
전도성을 갖는 이유 : 전리/해리되어 분리되는, 전하를 가진 이온이 전류를 나르는 매개체가 되기 때문
전해질의 종류 :
1) 이온결합으로 되어 순수한 상태에서 이온으로 되어있는 물질 ex. NaCl, (NH₄)₂SO₄
2) 순수한 상태에서는 이온을 함유하지 않으나 물에 녹으면 물과 반응하여 이온을 생성하는 물질 ex. HCl, NH3
전리/해리(ionization) : 전해질이 용매에 녹아 이온으로 분리되는 현상 (평형상태가 될 수 있음)
- 전리하는 정도는 전해질의 고유한 특성으로, 물질마다 그 정도에 차이가 있음 -> 전리도( α , degree of ionization) 로 표현 -> 강전해질(수용액 중 전부/대부분 전리 ex, NaCl, HCl), 약전해질(일부분만 전리 ex, 초산CH3COOH, 옥살산C2H2O4)
-전리도 α = (전리된 양) / (전해질 전체량 1.0) -> 동일한 물질이라도 용액의 농도에 따라 다르다.
* 약산의 경우처럼 전리도 α 가 1보다 매우 작을 경우 ( α << 1 ) -> 평형상수 K=Ca^2으로 근사할수있음
-> 전리도 α = \(\sqrt{\dfrac{K}{C}}\) (K는 전리상수, C는 전해질의 초기농도(전체농도))
* K값이 큰 강전해질은 K값이 작은 약전해질보다 전리도가 크다. (당연)
* 같은 물질이면 농도가 묽을수록 전리도가 높다.
* 한 전해질의 전리평형상수(전리상수)는 용액 중에 존재하는 다른 이온의 영향을 받는다.
예를 들어, NaCl 용액 중에서 아세트산의 전리상수는 용액의 NaCl 농도가 진해짐에 따라 커진다.
그 이유는 : 해리된 소량의 아세트이온 주변에 강전해질에서 온 다량의 소듐이온이 둘러싸이게 되어 -> 유효음전하가 감소해 -> 평형이 아세트이온으로 많이 전리되는 방향으로 이동하기 때문이다.
이 현상은 양이온의 주변에도 발생해서 -> 결국 아세트이온과 수소이온의 정전기적 인력은 순수한 물 용매일때보다 줄어들고 -> 결국 서로 결합하려는 경향이 감소해서 해리가 증가한다.
이 같은 현상은 난용성염의 용해 등과 같은 경우에서도 관찰된다.


=> 이처럼, 화학평형상수는 일반적으로 용액 중에 녹아있는 전해질 농도, 즉 '이온세기'( μ )의 영향을 받는다.
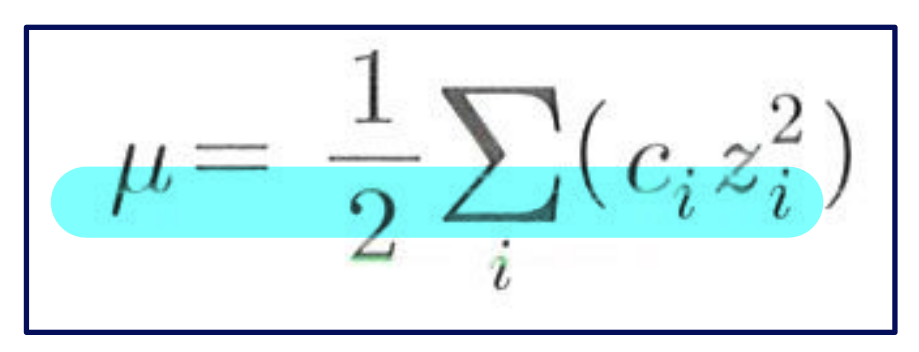
c는 화학종의 몰농도,
z는 화학종의 전하
4. 활동도
무한히 묽은 용액에서, 화학평형상수는 온도가 일정하면 항상 일정한 값을 가짐 (온도는 농도, 압력, 촉매와는 달리 K값을 변화시킬수있음)
그러나, 농도가 진해지면, 화학평형상수는 다소 변화함
이는 이온의 농도가 높아짐에 따라 이온간의 상호작용이 점점 커져 이온의 활동이 억제되기 때문임 -> 실제 반응에 유효한 농도는 이온의 농도보다 작음 -> 이를 활동도 A 로 나타냄 (activity)
활동도 A : 화학종이 용액 중에서 실제로 발휘하는 반응 능력을 표시한 값
- 농도에 비례함 -> 이때의 비례상수를 활동도계수 γ라고 함
\(A_{x}=\left[ x\right] _{eq}\gamma _{x}\)
(Ax는 화학종 x의 활동도, [x]는 x의 몰농도, γ x는 x의 활동도계수)
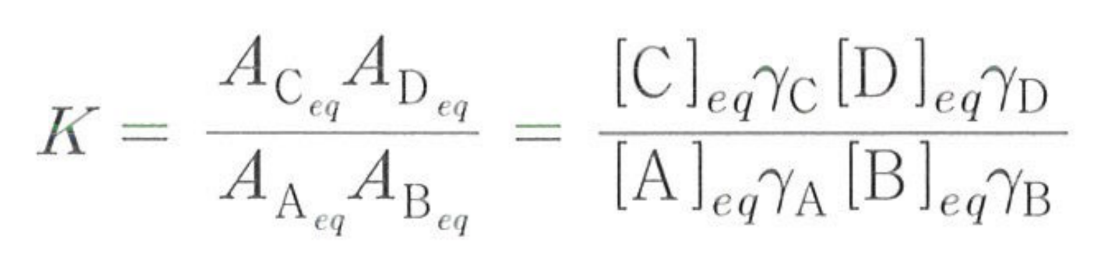
활동도계수 γ : Debye-Huckel 식으로 구함
\(\log \gamma =\dfrac{-0.51z^{2}\sqrt{\mu }}{1+0.33r\sqrt{\mu }}\)
여기서 r은 이온과 그 주위에 결합된 용매 분자 층을 합한 이온의 수화반지름이고, 단위는 옴스트롱(Å)(10^(-8)cm)이다.
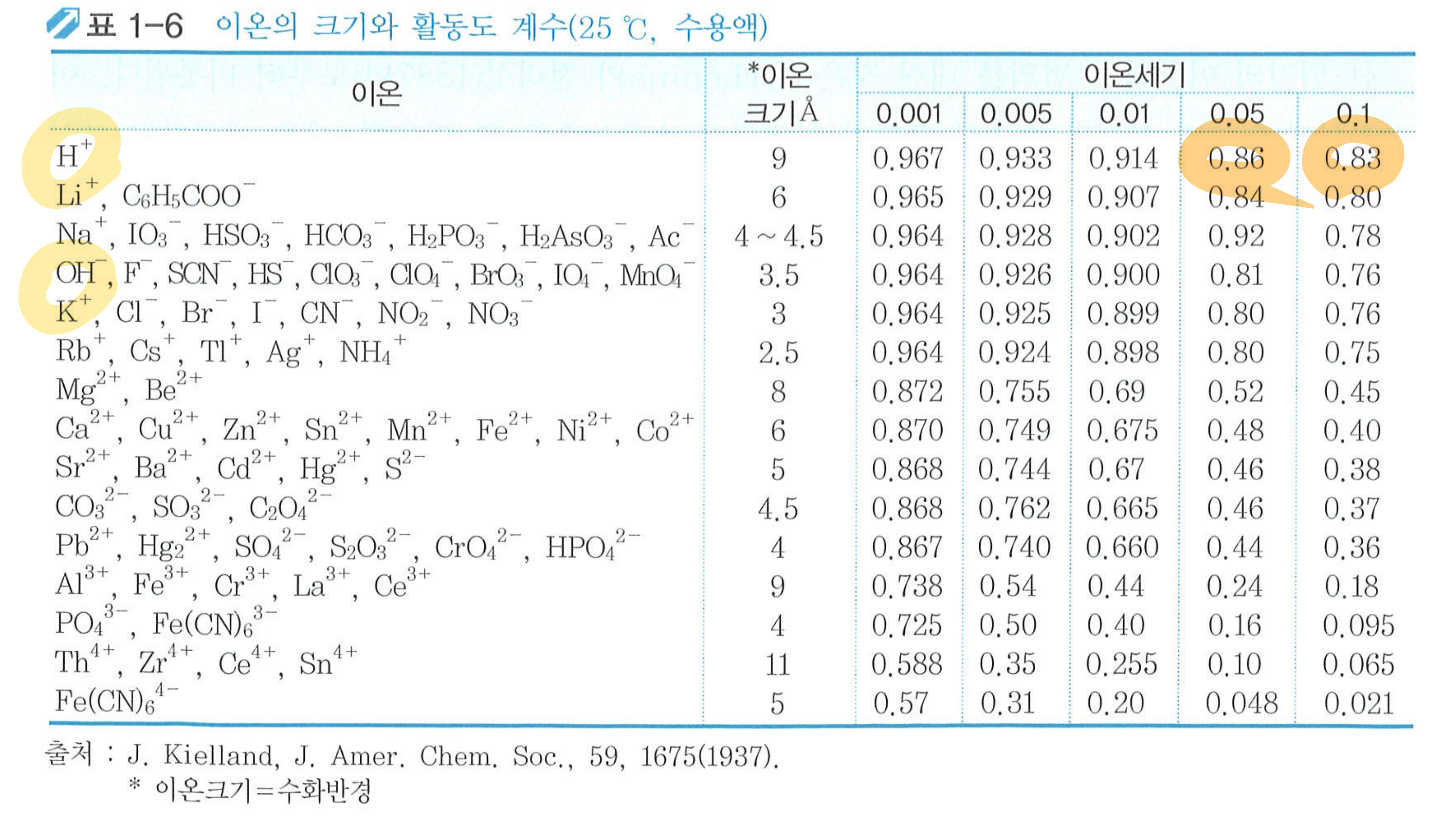
- 1mol/L보다 연한 용액에서, 이온세기가 증가하면 활동도 계수는 감소한다.
- 1mol/L 이상의 용액에서, 이온세기가 증가하면 활동도 계수도 증가한다.
- 무한히 묽은 용액에서 활동도계수는 1이다. (이때 활동도와 농도는 같다)
- 보통 용액에서는 활동도계수가 1보다 작다.
- 이온세기가 같은 경우) 이온전하가 증가하면 활동도 계수는 감소한다.
- 이온전하가 같은 경우) 수화반지름이 작을수록 활동도 계수가 감소한다.
- 중성분자, 대부분의 기체와 고체(결정체)의 경우 활동도계수를 1로 본다.
- 대부분의 경우에 (표준상태) 활동도계수를 1로 보고, 고전적평형상수를 사용한다.
~1.2.2까지
'2학년 > 의약품분석학' 카테고리의 다른 글
| 1-2 화학평형 - 3) 산염기와 물의 해리 (1) | 2023.12.28 |
|---|---|
| 1-1 화학분석과 용액의 농도 (1) | 2023.12.21 |

